化學】“化學反應速率和化學平衡”知識點歸納
一、化學反應速率
1、化學反應速率
(1)化學反應速率的概念
化學反應速率是用來衡量化學反應進行的快慢程度的物理量。
(2)化學反應速率的表示方法
對于反應體系體積不變的化學反應,通常用單位時間內反應物或生成物的物質的量濃度的變化值表示。
某一物質A的化學反應速率的表達式為:
式中某物質A的濃度變化,常用單位為mol·L-1。某段時間間隔,常用單位為s,min,h。υ為物質A的反應速率,常用單位是mol·L-1·s-1,mol·L-1·s-1等。
(3)化學反應速率的計算規律
①同一反應中不同物質的化學反應速率間的關系
同一時間內,用不同的物質表示的同一反應的反應速率數值之比等于化學方程式中各物質的化學計量數之比。
②化學反應速率的計算規律
同一化學反應,用不同物質的濃度變化表示的化學反應速率之比等于反應方程式中相應的物質的化學計量數之比,這是有關化學反應速率的計算或換算的依據。
(4)化學反應速率的特點
①反應速率不取負值,用任何一種物質的變化來表示反應速率都不取負值。
②同一化學反應選用不同物質表示反應速率時,可能有不同的速率數值,但速率之比等于化學方程式中各物質的化學計量數之比。
③化學反應速率是指時間內的“平均”反應速率。
小貼士:
①化學反應速率通常指的是某物質在某一段時間內化學反應的平均速率,而不是在某一時刻的瞬時速率。
②由于在反應中純固體和純液體的濃度是恒定不變的,因此對于有純液體或純固體參加的反應一般不用純液體或純固體來表示化學反應速率。其化學反應速率與其表面積大小有關,而與其物質的量的多少無關。通常是通過增大該物質的表面積(如粉碎成細小顆粒、 充分攪拌、 振蕩等)來加快反應速率。
③對于同一化學反應,在相同的反應時間內,用不同的物質來表示其反應速率,其數值可能不同,但這些不同的數值表示的都是同一個反應的速率。因此,表示化學反應的速率時,必須指明是用反應體系中的哪種物質做標準。
2、化學反應速率的測量
(1)基本思路
化學反應速率是通過實驗測定的。因為化學反應中發生變化的是體系中的化學物質(包括反應物和生成物),所以與其中任何一種化學物質的濃度(或質量)相關的性質在測量反應速率時都可以加以利用。
(2)測定方法
①直接可觀察的性質,如釋放出氣體的體積和體系的壓強。
②依靠科學儀器才能測量的性質,如顏色的深淺、光的吸收、光的發射、導電能力等。
③在溶液中,當反應物或產物本身有比較明顯的顏色時,常常利用顏色深淺和顯色物質濃度間的正比關系來跟蹤反應的過程和測量反應速率。
-
本節知識樹:
準確表達化學反應進行的快慢,就必須建立一套方法:確定起點,確定反應時間的單位,找到易于測量的某種量或性質的變化。

二、影響化學反應速率的因素
1、發生化學反應的前提——有效碰撞理論
(1)有效碰撞:能夠發生化學反應的碰撞。
化學反應發生的先決條件是反應物分子之間必須發生碰撞。
反應物分子之間的碰撞只有少數碰撞能導致化學反應的發生,多數碰撞并不能導致反應的發生,是無效碰撞。碰撞的頻率越高,則化學反應速率就越大。
(2)活化能和活化分子
①活化分子:在化學反應中,能量較高,有可能發生有效碰撞的分子。
活化分子之間之所以能夠發生有效碰撞,是由于它們的能量高,發生碰撞時,能夠克服相撞分子之間的排斥力,破壞分子內部原子之間的“結合力” ,從而導致反應物分子破壞,重新組合成生成物分子,發生化學反應。
②活化能:活化分子所多出的那部分能量(或普通分子轉化成活化分子所需的最低能量)。
③活化能與化學反應速率:活化分子數目的多少決定了有效碰撞發生的次數。在分子數確定時,活化分子百分數增大,有效碰撞的次數增多,反應速率加快。
2、決定化學反應速率的內部因素
不同的化學反應具有不同的反應速率,影響反應速率的主要因素是內因,即參加反應的物質本身的性質。
內因:參加反應的物質的性質和反應的歷程,是決定化學反應速率的主要因素。
3、影響化學反應速率的外部因素
當物質確定時 (即內因固定),在同一反應中,影響反應速率的因素是外因,即外界條件,主要有溫度、濃度、壓強、催化劑等。
(1)濃度對化學反應速率的影響
①規律:其他條件不變時,增大反應物的濃度,可以加快反應速率;減小反應物的濃度,可以減慢化學反應的速率。
②理論解釋:在其他條件不變時,對某一反應來說,活化分子百分數是一定的,即單位體積內的活化分子數與反應物的濃度成正比。
(2)壓強對反應速率的影響
①影響對象: 壓強只影響有氣體參與的反應的反應速率對于沒有氣體參與的反應,壓強對它的反應速率沒有任何影響。
注:壓強影響,只適用于討論有氣體參加的反應,當然并不一定參加反應的物質全部是氣體,只要有氣體參與,壓強即會影響反應的反應速率。
②規律:對于有氣體參加的反應,若其他條件不變,增大壓強,反應速率加快;減小壓強,反應速率減慢。
③理論解釋:對氣體來說,若其他條件不變,增大壓強,是增大了濃度單位體積內活化分子數增多 有效碰撞次數增多 化學反應速率增大。因此,增大壓強,可以增大化學反應速率。
(3)溫度對反應速率的影響
①規律:其他條件不變時,升高溫度,可以增大反應速率,降低溫度,可以減慢反應速率。
②理論解釋:溫度是分子平均動能的反映,溫度升高,使得整個體系中分子的能量升高,分子運動速率加快。
(4)催化劑對反應速率的影響
①規律:催化劑可以改變化學反應的速率。在不加說明時,催化劑一般指使反應速率加快的正催化劑。
②催化劑影響化學反應速率的原因:在其他條件不變時, 使用催化劑可以大大降低反應所需要的能量,會使更多的反應物分子成為活化分子,大大增加活化分子百分數,因而使反應速率加快。同一催化劑能同等程度地改變正、逆反應的速率。
-
本節知識樹:
反應物的性質是影響反應速率的內在因素。外界因素對反應速率的影響用有效碰撞理論解釋。

三、化學平衡
1、化學平衡狀態
(1)溶解平衡狀態的建立:當溶液中固體溶質溶解和溶液中溶質分子聚集到固體表面的結晶過程的速率相等時,飽和溶液的濃度和固體溶質的質量都保持不變,達到溶解平衡。溶解平衡是一種動態平衡狀態。
小貼士:
①固體溶解過程中,固體的溶解和溶質分子回到固體溶質表面這兩個過程一直存在,只不過二者速率不同,在宏觀上表現為固體溶質的減少。當固體全部溶解后仍未達到飽和時,這兩個過程都不存在了。
②當溶液達到飽和后,溶液中的固體溶解和溶液中的溶質回到固體表面的結晶過程一直在進行,并且兩個過程的速率相等,宏觀上飽和溶液的濃度和固體溶質的質量都保持不變,達到溶解平衡狀態。
(2)可逆反應與不可逆反應
①可逆反應:在同一條件下,同時向正、 反兩個方向進行的化學反應稱為可逆反應。
前提:反應物和產物必須同時存在于同一反應體系中,而且在相同條件下,正、逆反應都能自動進行。
②不可逆反應:在一定條件下,幾乎只能向一定方向(向生成物方向)進行的反應。
(3)化學平衡狀態的概念:化學平衡狀態指的是在一定條件下的可逆反應里,正反應速率和逆反應速率相等,反應混合物中各組分的濃度保持不變的狀態。
理解化學平衡狀態應注意以下三點:
①前提是“一定條件下的可逆反應” ,“一定條件” 通常是指一定的溫度和壓強。
②實質是“正反應速率和逆反應速率相等” ,由于速率受外界條件的影響,所以速率相等基于外界條件不變。
③標志是“反應混合物中各組分的濃度保持不變” 。濃度沒有變化,并不是各種物質的濃度相同。對于一種物質來說,由于單位時間內的生成量與消耗量相等,就表現出物質的多少不再隨時間的改變而改變。
2、化學平衡移動
可逆反應的平衡狀態是在一定外界條件下(濃度、溫度、壓強)建立起來的,當外界條件發生變化時,就會影響到化學反應速率,當正反應速率不再等于逆反應速率時,原平衡狀態被破壞,并在新條件下建立起新的平衡。此過程可表示為:
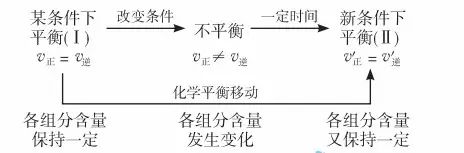
(1)化學平衡移動:可逆反應中舊化學平衡的破壞、新化學平衡的建立過程。
(2)化學平衡移動的原因:反應條件的改變,使正、逆反。應速率發生變化,并且正、逆反應速率的改變程度不同,導致正、逆反應速率不相等,平衡受到破壞,平衡混合物中各組分的含量發生相應的變化。
①若外界條件改變,引起υ正>ν逆時,正反應占優勢,化學平衡向正反應方向移動,各組分的含量發生變化;
②若外界條件改變,引起υ正<ν逆時,逆反應占優勢,化學平衡向逆反應方向移動,各組分的含量發生變化;
③若外界條件改變,引起υ正和ν逆都發生變化,如果υ正和ν逆仍保持相等,化學平衡就沒有發生移動,各組分的含量從保持一定到條件改變時含量沒有變化。
(3)濃度對化學平衡的影響
在其他條件不變的情況下:
增大反應物的濃度,平衡向正反應方向移動,使反應物的濃度降低;
減小產物的濃度,平衡向正反應方向移動,使產物的濃度增大;
增大產物的濃度,平衡向逆反應方向移動,使產物的濃度降低;
減小反應物的濃度,平衡向逆反應方向移動,使反應物的濃度增大。
(4)壓強對化學平衡的影響
在其他條件不變的情況下,對于有氣體參加或者生成的反應,增大壓強,會使氣體的濃度增大相同的倍數,正、逆反應速率都增加,化學平衡向著氣體體積縮小的反應方向移動;
減小壓強,會使氣體的濃度減小相同的倍數,正、逆反應速率都減小,會使化學平衡向著氣體體積增大的反應方向移動。
(5)溫度對化學平衡的影響
在其他條件不變的情況下,溫度升高,化學平衡向著吸熱反應方向移動;溫度降低,化學平衡向著放熱反應方向移動。
(6)催化劑對化學平衡的影響
使用催化劑不影響化學平衡的移動。由于催化劑可以改變化學反應速率,而且對于可逆反應來說,催化劑對正反應速率與逆反應速率影響的程度是等同的,所以平衡不移動。但應注意,雖然催化劑不使化學平衡移動,但使用催化劑可影響可逆反應達到平衡的時間。
(7)勒夏特列原理
①原理內容:如果改變影響平衡的一個條件 (如溫度、壓強等),平衡就向能夠減弱這種改變的方向移動。
外界條件對化學平衡的影響見下表:
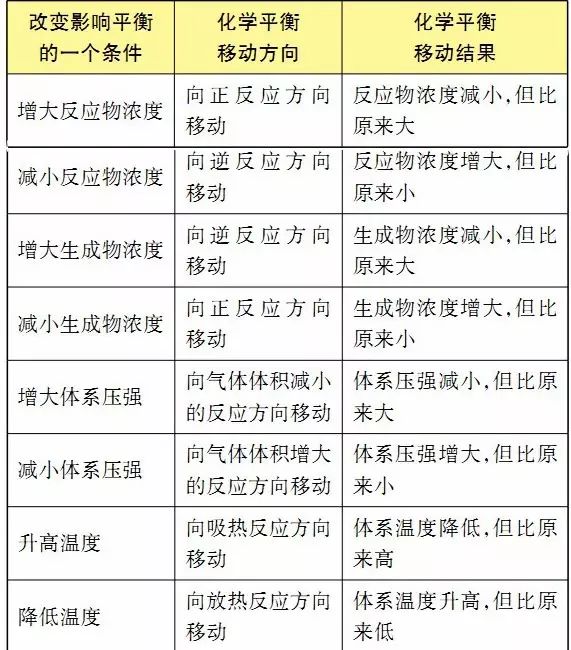
②適用范圍:勒夏特列原理適用于已達平衡的體系(如溶解平衡、化學平衡、電離平衡、水解平衡等)。勒夏特列原理不適用于未達平衡的體系。
3、化學平衡常數
(1)概念
在一定溫度下,當一個可逆反應達到平衡狀態時,生成物的平衡濃度用化學方程式中的化學計量數作為指數的乘積與反應物的平衡濃度用化學方程式中的化學計量數作為指數的乘積的比值是一個常數,這個常數叫做化學平衡常數,簡稱平衡常數。用符號K表示。
對于一般可逆反應:mA(g)+nB(g)=pC(g)+qD(g),在一定溫度下
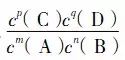
=K,K為常數,只要溫度不變,對于一個具體的可逆反應就對應一個具體的常數值。
(2)平衡表達式K的意義
①判斷可逆反應進行的方向
②表示可逆反應進行的程度
(3)平衡轉化率
含義:平衡轉化率是指用平衡時已轉化了的某反應物的量與反應前(初始時) 該反應物的量之比來表示反應在該條件下的最大限度。
-
本節知識樹:
在化學平衡概念的基礎上,從化學反應限度的定量描述和外界條件對化學平衡的影響兩個方面進一步學習了化學平衡的知識。

四、化學反應進行的方向
化學反應的方向
(1)自發過程和自發反應
自發過程: 在一定條件下不借助外部力量就能自動進行的過程。
自發反應:在一定的條件(如溫度、 壓強)下,一個反應可以自發進行到顯著程度,就稱自發反應。
非自發反應:不能自發地進行,必須借助某種外力才能進行的反應。
自發反應一定屬于自發過程。
(2)自發反應的能量判據
自發反應的體系總是趨向于高能狀態轉變為低能狀態 (這時體系往往會對外做功或釋放熱量),這一經驗規律就是能量判斷依據。
注:反應焓變是與反應能否自發進行有關的一個因素,但不是唯一的因素,并且自發反應與反應的吸放熱現象沒有必然的關系。
(3)自發反應的熵判據
①熵的含義:在密閉的條件下,體系由有序自發地轉變為無序的傾向,這種推動體系變化的因素稱作熵。熵用來描述體系的混亂度,符號為S。熵值越大,體系的混亂度越大。
注:自發的過程是熵增加的過程。熵增加的過程與能量狀態的高低無關。熵變是與反應能否自發進行有關的又一個因素,但也不是唯一的因素。
②熵增加原理:自發過程的體系趨向于有序轉變為無序,導致體系的熵增加,這一經驗規律叫做熵增加原理,也是反應方向判斷的熵依據。與有序體系相比,無序體系“更加穩定” 。
③反應的熵變
化學反應存在著熵變。反應的熵變( 雜)為反應產物總熵與反應物總熵之差。對于確定的化學反應,在一定條件下具有確定的熵變。
常見的熵增加的化學反應:產生氣體的反應,氣體物質的量增大的反應,熵變的數值通常都是正值,為熵增加反應。
常見的熵減少的化學反應:有些熵減小的反應即 雜 約 園 的反應在一定條件下也可以自發進行,如鋁熱反應。
(4)自發反應的復合判據
化學反應方向的復合判據在溫度、壓強一定的條件下,化學反應的方向是反應的焓變和熵變共同影響的結果,反應方向的判據為:

-
本節知識樹:
化學反應的方向由反應體系的某些物理量決定。等溫、等壓條件下,化學反應的方向由反應焓變與反應熵變共同決定。

-
本章知識網絡:












